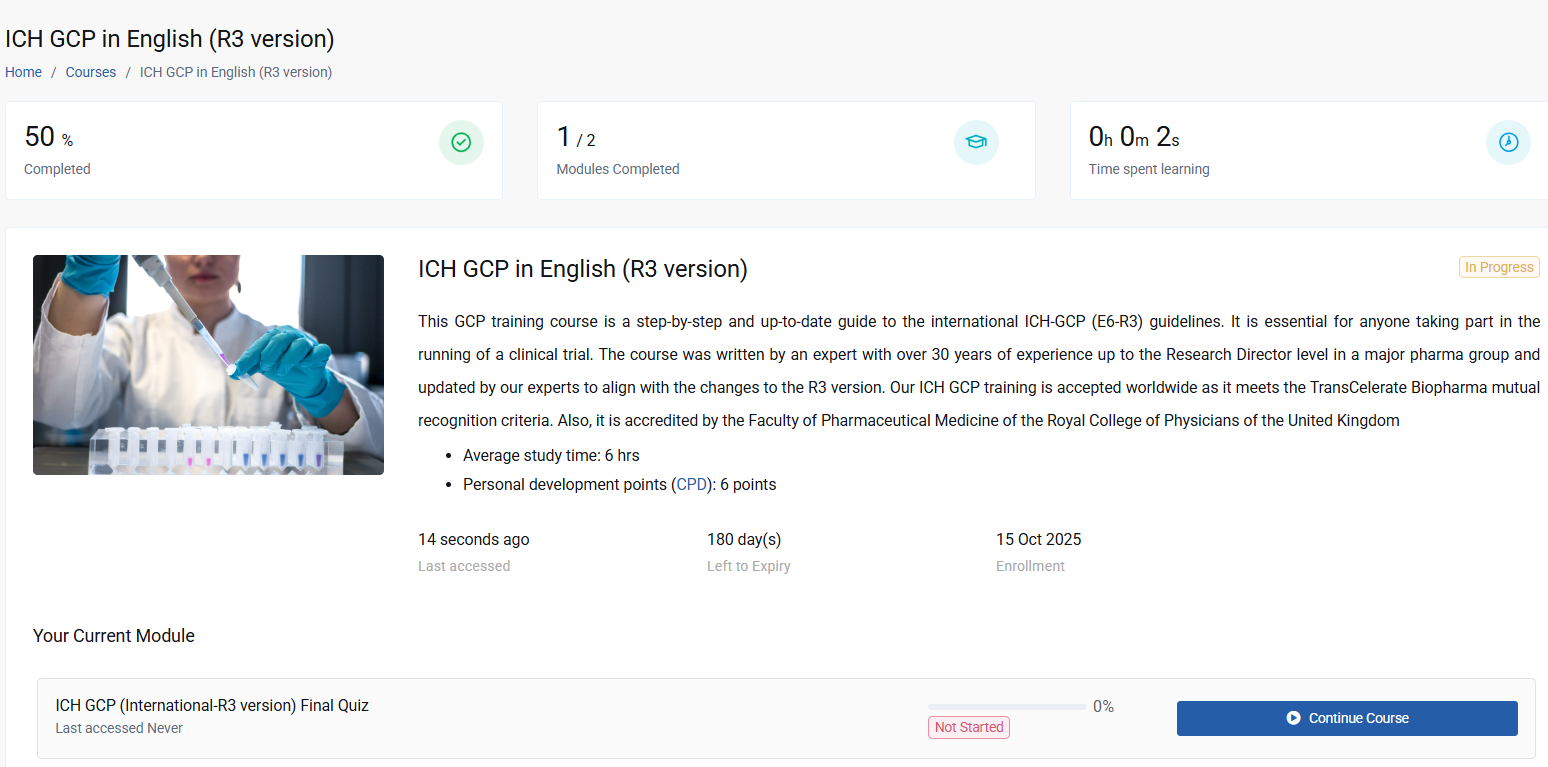
I have finalised the demo for the ICH-GCP E6 R3 refresher course. Overall, I liked the content and the interface. I also want to thank Whitehall Train...
About
Scritto da un esperto con oltre 30 anni di esperienza fino al livello di Direttore della Ricerca in un importante gruppo farmaceutico, questo corso di formazione GCP copre le più recenti linee guida internazionali ICH-GCP (E6-R3) e le ulteriori normative essenziali per la pratica clinica.
Course Syllabus
- La storia di GCP: Parte 1
- La storia di GCP: Parte 2
- La storia di GCP: Parte 3
- La storia di GCP: Parte 4
- Che cos'è GCP?
- I principi dell'ICH GCP: Parte 1
- I principi dell'ICH GCP: Parte 2
- Punti di apprendimento aggiuntivi
- Documentazione e Controllo di Versione
- Assicurazione Qualità (QA)
- Risorse Chiave: Parte 1
- Risorse Chiave: Parte 2
- Introduzione: Parte 1
- Introduzione: Parte 2
- Introduzione: Parte 3
- Introduzione: Parte 4
- Introduzione: Parte 5
- Introduzione: Parte 6
- Introduzione: Parte 7
- Introduzione: Parte 8
- Introduzione: Parte 9
- Responsabilità dell'Autorità Regolatoria
- Responsabilità dell'IEC
- Moduli di Consenso Informato del Soggetto (ICF) Parte 1
- Moduli di Consenso Informato del Soggetto (ICF): Parte 2
- Composizione, Funzioni, Operazioni, Procedure e Registrazioni
- Interazioni dell'IEC con Sponsor e Sperimentatori
- Introduzione
- Responsabilità dello sperimentatore
- Qualifiche e accordi dello sperimentatore
- Risorse adeguate
- Assistenza medica ai soggetti dello studio: Parte 1
- Assistenza medica ai soggetti dello studio: Parte 2
- Comunicazione con l'IRB/IEC
- Conformità al protocollo
- Medicinali sperimentali
- Procedure di randomizzazione e apertura del cieco
- Consenso informato: Introduzione
- Consenso informato: Discussione sul consenso
- Consenso informato: Soggetti che non sanno leggere o scrivere
- Consenso informato: Minori e soggetti mentalmente incapaci
- Consenso informato: Soggetti incapaci
- Consenso informato: Aggiornamento del consenso
- Documenti e relazioni: Introduzione
- Documenti e relazioni: File del sito di studio
- Documenti e relazioni: Aggiornamenti e modifiche
- Documenti e relazioni: Documenti sorgente
- Documenti e relazioni: Informazioni finanziarie
- Documenti e relazioni: Modulo di registrazione del caso
- Documenti e relazioni: Registrazione dei dati dei soggetti
- Interruzione o sospensione anticipata di uno studio
- Relazioni sullo stato di avanzamento e relazioni finali dello sperimentatore
- Responsabilità dello sperimentatore
- Introduzione: Parte 1
- Introduzione: Parte 2
- Introduzione: Parte 3
- Gestione della Qualità: Parte 1
- Gestione della Qualità: Parte 2
- Gestione della Qualità - Parte 3
- QA e QC (Assicurazione e Controllo Qualità): Introduzione
- QA e QC (Assicurazione e Controllo Qualità): Procedure Operative Standard
- QA e QC (Assicurazione e Controllo Qualità): Accordi e Contratti
- Organizzazioni di Ricerca a Contratto
- Disegno di Studio
- Gestione dello Studio: Introduzione
- Gestione dello Studio: Gestione dei Dati
- Gestione dello Studio: Dati Elettronici
- Gestione dello Studio: Conservazione dei Documenti
- Selezione dello Sperimentatore: Introduzione
- Selezione dello Sperimentatore: Autorizzazioni
- Selezione dello Sperimentatore: Responsabilità
- Selezione dello Sperimentatore: Compenso
- Finanziamento
- Notifica/Presentazione alle Autorità Regolatorie
- Conferma della Revisione da parte di IRB/IEC
- Informazioni sull'IMP
- Produzione, confezionamento, etichettatura e codifica dei prodotti sperimentali: Parte 1
- Produzione, confezionamento, etichettatura e codifica dei prodotti sperimentali: Parte 2
- Fornitura e gestione dei prodotti sperimentali
- Accesso ai record
- Gestione dei dati I
- Gestione dei dati II
- Gestione dei dati III
- Gestione dei dati IV
- Gestione dei dati V
- Gestione dei dati VI
- Programmazione statistica e analisi dei dati I
- Programmazione statistica e analisi dei dati II
- Conservazione e archiviazione dei dati
- Audit e ispezione
- Non conformità
- Interruzione o sospensione anticipata di uno studio clinico: Parte 1
- Interruzione o sospensione anticipata di uno studio clinico: Parte 2
- Rapporti di studi clinici
- Studi multicentrici
- Introduzione
- Governance dei dati - Parte 1
- Governance dei dati - Parte 2
- Mantenere la cieca
- Ciclo di vita dei dati I
- Ciclo di vita dei dati II
- Ciclo di vita dei dati III
- Ciclo di vita dei dati IV
- Sistemi informatizzati I
- Sistemi informatizzati II
- Sistemi informatizzati III
- Sistemi informatizzati IV
- Sistemi informatizzati V
- Sistemi informatizzati VI
- Sistemi informatizzati VII
- Introduzione
- Monitor
- La visita di monitoraggio: Parte 1
- La visita di monitoraggio: Parte 2
- Verifica dell'IMP
- Conformità al protocollo, agli emendamenti, alle procedure operative standard e alle linee guida
- Verifica del consenso informato
- Il modulo di registrazione del caso (CRF) e i documenti originali
- Verifica dei dati del soggetto
- Chiusura della visita di monitoraggio
- Il rapporto e il piano di monitoraggio
- Gestione della qualità - Monitoraggio centralizzato
- Frodi e condotte illecite: Parte 1
- Frodi e condotte illecite: Parte 2
- Introduzione
- Eventi avversi, reazioni avverse al farmaco e reazioni avverse gravi (SUSAR)
- Eventi avversi gravi (SUSAR)
- Eventi avversi di particolare interesse
- Rapporti periodici di sicurezza
- Introduzione
- Struttura e contenuto del protocollo: Parte 1
- Struttura e contenuto del protocollo: Parte 2
- Struttura e contenuto del protocollo: Parte 3
- Introduzione
- Struttura e contenuto della brochure per gli investigatori
- Introduzioni
- Archiviazione
- Documenti da presentare prima dello studio
- Documenti da presentare dopo lo studio
- Glossario e abbreviazioni
- Documenti guida UE
- Documenti guida ICH
- Documenti guida FDA statunitense
- Elenco delle autorità competenti globali
Our Certified Customers
Learner Rating & Reviews
Frequently Asked Questions
Good Clinical Practice (GCP) training is a vital educational programme designed to arm researchers and clinical trial professionals with essential knowledge of ethical and scientific standards. These standards are crucial for executing high-quality clinical trials. The training encompasses the globally acknowledged guidelines set forth by the International Council for Harmonisation (ICH).
The key objectives of GCP training include:
- Safeguarding the rights, safety, and welfare of human participants
- Upholding the accuracy and reliability of data collected during clinical trials
- Fostering uniform, superior practices across all facets of clinical research
Whitehall Training's Good Clinical Practice Course thoroughly explores these critical areas. Our comprehensive programme equips learners with a robust understanding of GCP principles and their practical implementation in real-world clinical research scenarios. By completing this course, participants gain the necessary skills to conduct clinical trials that meet the highest standards of ethical and scientific rigour.
Absolutely. For those involved in clinical trials, GCP certification isn’t just valuable—it’s essential. But even if you’re not directly participating in trials, obtaining GCP certification offers numerous benefits:
- It demonstrates your commitment to upholding global research standards
- Your research gains added credibility and quality assurance
- You’ll be better equipped to safeguard the rights and wellbeing of study participants
- Your career opportunities in the clinical research sector may expand significantly
Our Whitehall Training Good Clinical Practice Course goes beyond mere certification. We provide you with practical, hands-on knowledge that you can immediately apply in your professional endeavours. By mastering GCP principles through our course, you’ll be well-prepared to navigate the complexities of clinical research with confidence and expertise.
Good Clinical Practice (GCP) certification is crucial for a broad spectrum of individuals working in clinical research:
- Lead Researchers and Co-investigators: These are the primary and supporting scientists responsible for overseeing and conducting trials at research facilities.
- On-site Trial Team: This includes study coordinators, research nurses, and other personnel involved in the day-to-day management of clinical trials.
- Trial Sponsors and Research Organisations: Professionals who manage the overall planning, commencement, and documentation of clinical studies.
- Regulatory Bodies: Officials tasked with supervising and assessing trial compliance with established standards.
- Ethics Committees: Groups responsible for reviewing and approving proposed trial protocols to ensure ethical conduct.
- University and Research Centre Staff: Individuals ensuring that institutional research aligns with international benchmarks.
- Researchers Funded by National Health Organisations: All scientists and support staff engaged in publicly funded clinical trials.
Our comprehensive GCP course is designed to meet the needs of this varied audience, offering both universal principles and role-specific guidance. Additionally, it serves as an excellent resource for those aiming to enhance their research capabilities and refine their approach to clinical trial operations. The Whitehall Training Good Clinical Practice Course provides tailored content to address the unique requirements of each of these professional groups, ensuring that all participants gain the knowledge necessary for their specific roles in the clinical research process.
Our Good Clinical Practice (GCP) course is designed to provide comprehensive coverage of the ICH-GCP (E6-R3) international guidelines, ensuring you meet the necessary training requirements for participation in international clinical trials. We offer this course in multiple languages to cater to a diverse audience.
This course serves as a detailed, step-by-step guide to the most recent ICH-GCP (E6-R3) guidelines, making it an indispensable resource for anyone involved in clinical trial management. The content has been meticulously crafted by an industry veteran with over three decades of experience, including a tenure as Research Director at a leading pharmaceutical company.
We’re proud to offer a course that’s accredited by the Faculty of Pharmaceutical Medicine of the Royal College of Physicians of the United Kingdom. This accreditation underscores the quality and relevance of our training material. To accommodate our global learners, we’ve made the course available in ten languages: English, German, Bulgarian, French, Italian, Japanese, Polish, Portuguese, Russian, and Spanish. Additionally, we’ve developed region-specific versions tailored to the regulatory frameworks of Australia, the UK, the US, France, Germany, and Latin America.
Our course stands out for its user-friendly design and clear visual presentation. This format allows for easy navigation and reference to the ICH-GCP E6 document. Drawing from the author’s extensive industry experience, the course offers practical insights into the application of GCP principles.
Upon completion, participants can earn 6 Continuing Professional Development (CPD) points, further enhancing the value of this training programme.
Indeed, our GCP course has received certification from the Faculty of Pharmaceutical Medicine at the Royal College of Physicians. This prestigious body, established in 1989, is renowned for its role in setting stringent research standards and serves as the professional membership organisation for pharmaceutical physicians across the United Kingdom.
The certification bestowed upon our course is a testament to its quality and relevance. It signifies that our programme meets exacting industry and academic criteria, providing you with a qualification that is widely acknowledged and respected within the field. By completing this certified course, you can be confident that you’re receiving training that aligns with the most current and rigorous standards in pharmaceutical research and practice.
The price of GCP certification can fluctuate based on several key factors:
- Endorsement: Has the course received approval from official bodies?
- Validity: Does the training meet ICH standards, allowing researchers to engage in global clinical studies?
- Content quality: Is the material current and authored by an industry expert?
- Duration of access: For how long can students utilise the course materials?
Our Whitehall Training GCP course is priced at £79, reflecting its high value across these areas:
- Endorsement: The Royal College of Physicians has accredited our course, awarding it 6 CPD points.
- Validity: Upon completion, researchers are equipped to participate in clinical trials, in line with ICH E6(R3) guidelines.
- Content quality: Lucy Parker, our GCP specialist with over ten years’ experience leading research at major institutions like the NHS, has crafted the course content.
- Duration of access: We support ongoing professional development by offering unlimited access to course materials.
For group purchases, we offer a 10% discount when buying 5 licences at checkout. If you’re interested in larger group discounts, please reach out to our team for a tailored quote.